Under Covid-pandemin spenderade den amerikanska regeringen miljarder dollar på nästan 400 produkter avsedda att skydda, diagnostisera och behandla hundratals miljoner människor – alla med etiketten "EUA" eller "Emergency Use Authorization."
Men vad betyder EUA egentligen?
Redan innan vi svarar på den frågan, och för att förstå var EUA står i förhållande till andra vägar för att godkänna eller godkänna medicinska produkter, är det bra att titta på vad EUA inte är:
EUA är inte en beteckning för en experimentell produkt som genomgår en klinisk prövning
Om vi bara förstår en sak om EUA borde det vara detta: EUA gäller inte för en produkt som genomgår en klinisk prövning som styrs av FDA-föreskrifter eller andra lagkrav.
EUA är inte heller detsamma som Expanded Access Use (EAU), ofta kallad "compassionate use", som gäller att ge patienter med svåra, obotliga sjukdomar tillgång till experimentella produkter innan de är helt godkända.
Detta bord från en Presentation av FDA-CDC 2020 sammanfattar skillnaderna mellan produkter som genomgår kliniska prövningar, produkter som ges till patienter genom utökad "medkännande" tillgång och produkter som godkänts genom EUA:
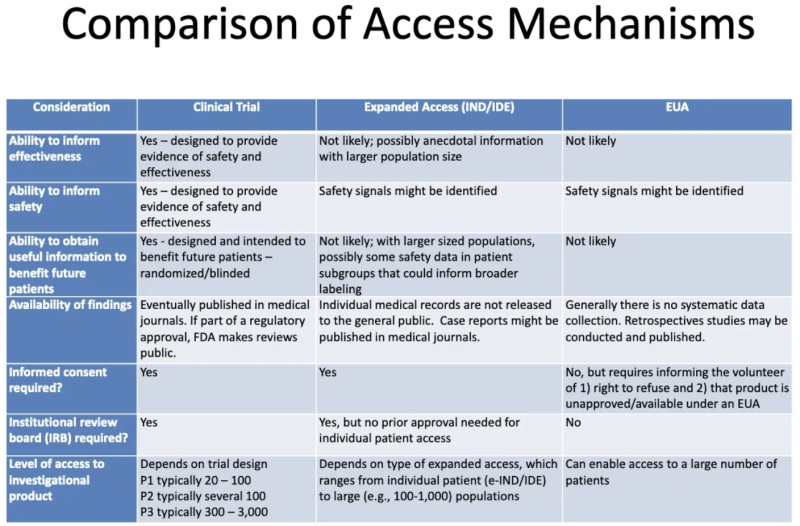
Här är vad den här tabellen berättar om EUA:
- Processen att bevilja EUA kommer sannolikt inte att generera någon information om en produkts effektivitet.
- Processen för att bevilja EUA är inte utformad för att ge bevis på säkerhet eller effektivitet, men säkerhetssignaler kan identifieras.
- Det är osannolikt, när en produkt väl har beviljats EUA och administrerats till vissa patienter, att någon användbar information kommer att erhållas till nytta för framtida patienter.
- Det finns ingen systematisk datainsamling om effektivitet eller säkerhet med EUA, och inga data publiceras i medicinska tidskrifter som en del av den regulatoriska godkännandeprocessen.
- Inget informerat samtycke krävs, men patienter som "volontär" att ta produkten måste få veta att de kan vägra och att produkten inte är godkänd/tillgänglig enligt EUA.
- Ingen institutionell granskningsnämnd (IRB) krävs. [IRB är en styrelse som är tänkt att skydda människors välbefinnande i kliniska prövningar]
För att ytterligare klargöra hur separat EUA är från alla normala godkännandeprocesser, i en 2009 Institute of Medicine of the National Academies publikation, hittar vi detta uttalande:
Det är viktigt att inse att en EUA inte är en del av utvecklingsvägen; det är en helt separat enhet som endast används i nödsituationer och är inte en del av läkemedelsgodkännandeprocessen. (sid. 28)
För att sammanfatta:
Processen att bevilja en produkt EUA kommer sannolikt inte att generera några bevis på säkerhet eller effektivitet. När en produkt väl har beviljats EUA och administrerats till patienter är det osannolikt att någon användbar information kommer att erhållas till nytta för framtida patienter, eftersom det inte finns någon systematisk datainsamling om effektivitet eller säkerhet.
Baserat på all denna mycket tydliga information från CDC/FDA och IMNA, skulle det vara rimligt att dra slutsatsen att nödtillstånd är en process som bör tillämpas mycket klokt och endast i akuta nödsituationer.
Låt oss nu titta på vilka typer av nödsituationer EUA är lagligt utformad för att hantera.
EAU är avsedd för WMD-nödsituationer
De lagar som tillåter EUA "Access Mechanism" som beskrivs ovan har utarbetats för fall av extrema, omedelbara nödsituationer som involverar massförstörelsevapen (WMD), även kallade CBRN (kemiska, biologiska, radiologiska, nukleära) medel.
Så här gör Food & Drug Administration (FDA) beskriver sina EUA-befogenheter:
Sektion 564 i FD&C Act (21 USC 360bbb – 3) tillåter FDA att stärka folkhälsoskyddet mot biologiska, kemiska, nukleära och radiologiska agens.
Med denna EUA-myndighet kan FDA hjälpa till att säkerställa att medicinska motåtgärder kan användas i nödsituationer för att diagnostisera, behandla eller förebygga allvarliga eller livshotande sjukdomar eller tillstånd orsakade av biologiska, kemiska, nukleära eller radiologiska agens när det inte finns några adekvata, godkända och tillgängliga alternativ (bland andra kriterier).
Dessa EUA-befogenheter beviljades 2004 under mycket specifika omständigheter relaterade till beredskap för attacker från CBRN-agenter.
Som förklarats i Harvard Law's Bill of Health,
I slutändan var det kriget mot terrorismen som skulle ge upphov till nödtillstånd. Efter händelserna den 11 september 2001 och efterföljande antraxpostattacker, antog kongressen Project Bioshield Act från 2004.
Smakämnen post indikerar att kongressen var fokuserad på hotet om bioterror specifikt, inte på att förbereda sig för en naturligt förekommande pandemi.
Med tanke på en så snäv typ av verkligt extrem nödsituation som involverar en massförstörelsevapen-attack, är det förståeligt varför EUA:s "åtkomstmekanism" inte kräver mycket regulatorisk tillsyn eller efterlevnad av några standarder för tillverkning eller kliniska prövningar.
Så vad kräver EUA-tillträdesmekanismen egentligen?
De tre stegen för nödtillstånd (EUA)
Tre saker måste hända för att EUA ska beviljas en medicinsk produkt:
- Secretary of Homeland Security, Secretary of Defense eller Secretary of Health and Human Services måste fastställa att det finns en nödsituation som involverar en attack eller ett hot om en attack med ett CBRN-agens eller en sjukdom orsakad av en sådan agent.
- FDA måste se till att den uppfyller fyra "lagstadgade kriterier" när den utfärdar EUA.
- FDA måste "ställa upp vissa obligatoriska villkor" i EUA.
EUA Steg 1: Deklarera en CBRN-nödsituation
Nödförklaringen för EUA är separat och inte relaterad till andra nödförklaringar som kan utfärdas av presidenten, HHS-sekreteraren eller någon annan. Den måste utfärdas specifikt i syfte att aktivera EUA och kan avslutas eller förlängas oberoende av någon annan nödförklaring.
Här är vad EUA-lagen säger är de fyra möjliga scenarierna för att aktivera EUA "åtkomstmekanismen:"
- ett beslut av Secretary of Homeland Security att det finns en inhemsk nödsituation, eller en betydande potential för en inhemsk nödsituation, som innebär en ökad risk för attack med ett eller flera biologiska, kemiska, radiologiska eller nukleära medel;
- ett beslut av försvarsministern att det finns en militär nödsituation, eller en betydande potential för en militär nödsituation, som innebär en ökad risk för United Stater militära styrkor, inklusive personal som verkar under ledning av avdelning 10 eller avdelning 50, av attack med—
- ett eller flera biologiska, kemiska, radiologiska eller nukleära medel; eller
- ett eller flera medel som kan orsaka, eller på annat sätt förknippas med, en överhängande livshotande och specifik risk för United Stater militära styrkor;
- ett beslut av Sekreterare [av Health and Human Services] att det finns en nödsituation för folkhälsan, eller en betydande potential för en nödsituation för folkhälsan, som påverkar, eller har en betydande potential att påverka, nationell säkerhet eller hälsa och säkerhet för United Stater medborgare som bor utomlands och som involverar ett eller flera biologiska, kemiska, radiologiska eller nukleära agens, eller en sjukdom eller ett tillstånd som kan hänföras till ett eller flera sådana agens; eller
- identifieringen av ett väsentligt hot enligt 319F–2 § i den Folkhälsovårdslagen [42 USC 247d–6b] tillräckligt för att påverka nationell säkerhet eller hälsa och säkerhet för United Stater medborgare som bor utomlands.
EUA Steg 2. Att uppfylla de lagstadgade kriterierna
När en av sekreterarna har förklarat att det finns en nödsituation som motiverar EUA, finns det ytterligare fyra "lagstadgade kriterier" som måste uppfyllas för att FDA ska kunna utfärda EUA. Så här förklarar FDA dessa krav:
- Allvarlig eller livshotande sjukdom eller tillstånd
För att FDA ska utfärda ett EUA måste CBRN-agensen som avses i HHS-sekreterarens EUA-deklaration kunna orsaka en allvarlig eller livshotande sjukdom eller tillstånd.
- Bevis på effektivitet
Medicinska produkter som kan komma i fråga för en EUA är de som "kan vara effektiva" för att förebygga, diagnostisera eller behandla allvarliga eller livshotande sjukdomar eller tillstånd som kan orsakas av ett eller flera CBRN-agens som identifierats i HHS-sekreterarens förklaring av nödsituation eller hot om nödsituation enligt avsnitt 564 (b).
Standarden "kan vara effektiv" för EUA ger en lägre nivå av bevis än den "effektivitet"-standard som FDA använder för produktgodkännanden. FDA avser att bedöma den potentiella effektiviteten av en möjlig EUA-produkt från fall till fall med hjälp av en risk-nytta-analys, som förklaras nedan.
[FET ANSIKTE TILLAGT]
- Risk-nytta analys
En produkt kan komma i fråga för en EUA om kommissionären fastställer att de kända och potentiella fördelarna med produkten, när den används för att diagnostisera, förebygga eller behandla den identifierade sjukdomen eller tillståndet, uppväger de kända och potentiella riskerna med produkten.
Vid fastställandet av om de kända och potentiella fördelarna med produkten uppväger de kända och potentiella riskerna, FDA tänker titta på den totala vetenskapliga bevisningen för att göra en övergripande bestämning av risk-nytta. Sådana bevis, som kunde uppstå från en mängd olika källor, kan innehålla (men är inte begränsat till): resultat från inhemska och utländska kliniska prövningar, in vivo-effektdata från djurmodeller och in vitro-data, tillgänglig för FDA-övervägande. FDA kommer också att bedöma kvaliteten och kvantiteten av tillgängliga bevis, med tanke på det aktuella läget för vetenskaplig kunskap.
[FET ANSIKTE TILLAGT]
- Inga alternativ
För att FDA ska utfärda ett EUA måste det inte finnas något adekvat, godkänt och tillgängligt alternativ till kandidatprodukten för att diagnostisera, förebygga eller behandla sjukdomen eller tillståndet. En potentiell alternativ produkt kan anses vara "inte tillgänglig" om det inte finns tillräckliga förråd av det godkända alternativet för att fullt ut tillgodose nödbehovet.
EUA Steg 3. Att införa de obligatoriska villkoren
När vi väl har den EUA-specifika nöddeklarationen och när FDA fastställer att produkten kan vara effektiv och att alla bevis som finns visar att fördelarna överväger riskerna, finns det ytterligare ett lager av relaterad reglering.
Här är hur en 2018 Congressional Research Service rapport om EUA förklarar detta:
FFDCA §564 uppmanar FDA att införa vissa obligatoriska villkor i en EUA och tillåter ytterligare diskretionära villkor där så är lämpligt. De erforderliga villkoren varierar beroende på om EUA är för en icke godkänd produkt eller för en icke godkänd användning av en godkänd produkt. För en icke godkänd produkt måste användarvillkoren:
(1) säkerställa att vårdpersonal som administrerar produkten får nödvändig information;
(2) säkerställa att individer till vilka produkten administreras får nödvändig information;
(3) tillhandahålla övervakning och rapportering av biverkningar i samband med produkten; och
(4) sörja för dokumentation och rapportering från tillverkaren.
Slutsats
Som nämnts i den här artikeln inser FDA/CDC tydligt att processen för att bevilja nödtillstånd (EUA) sannolikt inte kommer att generera någon information om effektiviteten eller säkerheten för en produkt. När vi tittar på bokstaven i lagen som styr EUA ser vi att detta verkligen är en korrekt bedömning.
EUA-lagen inför inga lagliga eller regulatoriska standarder som kan avgöra om en produkt är säker eller effektiv. De enda standarderna är om FDA anser att produkten kan vara effektiv och att dess kända fördelar överväger dess kända skador. Om det inte finns några kända skador eller kända fördelar, eftersom produkten aldrig har genomgått läkemedelsgodkännandeprocessen, kan FDA använda vilken information eller standard den väljer för att göra det beslutet.
Det följer av allt detta att ett företag vars produkt är en kandidat för EUA kan försöka demonstrera produktens säkerhet och/eller effektivitet på vilket sätt det än väljer. Förekomsten av ett sådant försök (oavsett om det är en klinisk prövning eller annan datainsamlingsmekanism), och hur försöket genomförs, är allt upp till företaget. Ingenting i EUA-lagen gäller hur företaget utformar, genomför eller analyserar några studier eller andra datainsamlingsmekanismer som det väljer att genomföra.
Tillämpat på Covid-produkter betyder detta:
- Inga säkerhets- eller effektdata från kliniska prövningar krävdes för att Covid-produkter skulle få EUA.
- Alla kliniska prövningar som hänvisas till i EUA-processen genomfördes utan några lagligt tillämpliga regulatoriska standarder.
- När vi får reda på att dessa produkter saknar effektivitet eller säkerhet är det ingen överraskning. Det är ett mycket troligt resultat av processen.
- Det finns inga data från EUA-processen som kan baseras på icke-EUA-beslut om produktens säkerhet eller effekt. Så all användning utan EUA av produkten skulle kräva att man går igenom den juridiska godkännandeprocessen för vanliga medicinska produkter från början.
Mer om godkännandeprocessen för Covid-vacciner här..
Återpublicerad från författarens understapel
Publicerad under a Creative Commons Erkännande 4.0 Internationell licens
För omtryck, vänligen ställ tillbaka den kanoniska länken till originalet Brownstone Institute Artikel och författare.









