In del ett av denna artikel, granskade jag det avtalsmässiga och regulatoriska ramverket som tillämpas av den amerikanska regeringen för den initiala utvecklingen, tillverkningen och förvärvet av Covid-mRNA-skotten, med hjälp av BioNTech/Pfizer-avtalen för att illustrera processen.
Jag visade att Emergency Use Authorization (EUA) beviljades dessa produkter baserat på kliniska prövningar och tillverkningsprocesser utförda med
- inga bindande juridiska standarder,
- ingen lagligt förbjuden säkerhetstillsyn eller reglering, och
- ingen rättslig upprättelse från tillverkaren för potentiella skador.
I denna uppföljande artikel kommer jag att ge en detaljerad analys av den underliggande dokumentationen.
Annan transaktionsmyndighet/överenskommelse (OTA): A Military Acquisition Pathway
Smakämnen överenskommelse mellan den amerikanska regeringen, representerad av Department of Defense (DoD), och Pfizer, som representerar BioNTech/Pfizer-partnerskapet, i juli 2020, för köp av ett "vaccin för att förhindra COVID-19" var inte ett vanligt förvärvskontrakt.
Det var ett avtal under Other Transaction Authority (OTA) – en förvärvsväg som enligt Riktlinjer för försvarsdepartementet, har använts sedan 1958 för att "tillåta en federal myndighet att ingå andra transaktioner än kontrakt, bidrag eller samarbetsavtal. "
[FET ANSIKTE TILLAGT]
En grundlig genomgång av DoD:s användning av OTA, inklusive dess lagstadgade historia, finns i 22 februari 2019 Congressional Research Service-rapport. Denna rapport, tillsammans med alla andra diskussioner om OTA, specificerar att det är en alternativ förvärvsväg för försvars- och militära ändamål. Den är inte avsedd, och har heller aldrig använts före Covid, för något avsett i första hand för civilt bruk.
Om du letar efter OTA-lagar i den amerikanska koden, det här är vägen du kommer att gå:
Armed Forces -> General Military Law -> Acquisition -> Research and Engineering -> Avtal -> DoD:s befogenhet att utföra vissa prototypprojekt
Denna rättsliga väg visar mycket tydligt att OTA-lagar är avsedda för förvärv av forsknings- och ingenjörsprototyper för de väpnade styrkorna.
Försvarsdepartementet har behörighet för tre olika typer av OT:er: (1) forsknings-OT:er, (2) prototyp-OT:er och (3) produktions-OT:er.
Dessa tre typer av OT representerar tre stadier av initial forskning, utveckling av en prototyp och eventuell produktion.
Inom dessa tre typer finns det specifika kategorier av projekt som OTA kan ansöka om:
- Ursprungligen, enligt OTA översikt tillhandahållen av DoD, var den andra transaktionsmyndigheten "begränsad till att gälla vapen eller vapensystem som föreslagits att förvärvas eller utvecklas av DoD."
- OTA utökades senare till att inkludera "alla prototypprojekt som är direkt relaterade till att förbättra uppdragseffektiviteten för militär personal och de stödjande plattformarna, systemen, komponenterna eller materialen som föreslagits att förvärvas eller utvecklas av DoD, eller till förbättring av plattformar, system, komponenter , eller material som används av Försvarsmakten.”
Än så länge låter inget av det som en förvärvsväg för miljontals nya medicinska produkter avsedda främst för civilt bruk.
Finns det något undantag för civil användning av OTA som kan gälla Covid mRNA-vaccin?
Smakämnen FY2004 National Defense Authorization Act (PL 108-136) innehöll ett avsnitt som gav Other Transaction Authority till "chefen för en verkställande myndighet som engagerar sig i grundforskning, tillämpad forskning, avancerad forskning och utvecklingsprojekt" som "har potential att underlätta försvar mot eller återhämtning från terrorism eller kärnkraft, biologisk, kemisk eller radiologisk attack."
Denna bestämmelse förlängdes till 2018, men verkar inte ha förlängts längre än det året. Observera också att även i detta exceptionella fall av icke-DoD-användning av OTA, situationen måste involvera terrorism eller en attack med massförstörelsevapen (CBRN).
Vilka andra OTA-lagar kan gälla?
2019 års CRS-rapport som citeras ovan tillhandahåller detta diagram, som visar att några icke-DoD-byråer har några OTA eller relaterade myndigheter:
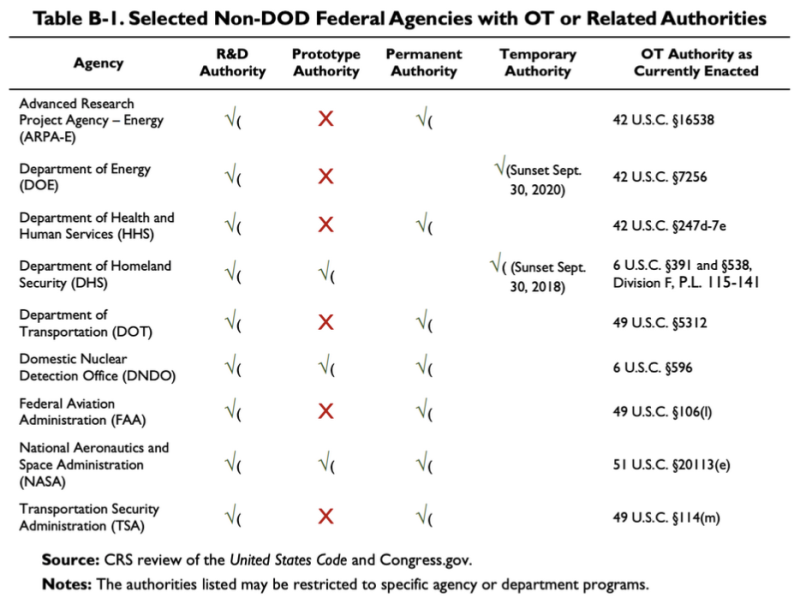
Enligt denna tabell har Department of Health and Human Services (HHS) viss forskning och utveckling (FoU) Andra transaktionsmyndigheter. Lagen som gäller OT Authority of HHS är 42 U.S.C. §247d-7e.
Var finns denna lag och vad säger den?
Folkhälsa och välfärd -> Folkhälsovård -> Allmänna befogenheter och skyldigheter -> Federal-State Cooperation -> Biomedical Advanced Research and Development Authority (BARDA) -> Transaktionsmyndigheter
Så det finns en plats i lagen relaterad till civil hälsa och välfärd där OTA kan vara tillämplig, även om den är giltig endast för forskning och utveckling, inte prototyper eller tillverkning.
Lagen säger att BARDA-sekreteraren har OT-behörighet
med avseende på en produkt som är eller kan bli en kvalificerad motåtgärd eller ett kvalificerad pandemi eller epidemiprodukt, verksamhet som övervägande—
i) utförs efter grundforskning och preklinisk utveckling av produkten; och
(ii) är relaterade till tillverkning av produkten i kommersiell skala och i en form som uppfyller de regulatoriska kraven enligt Federal Lagen om livsmedel, droger och kosmetika [21 USC 301 et seq.] eller under avsnitt 262 i denna titel.
[FET ANSIKTE TILLAGT]
De "regulatoriska kraven" som räknas upp i lagen innebär att det skulle vara omöjligt för BARDA/HHS att ingå avtal – även bara FoU – för några medicinska produkter (som mRNA-vaccinerna) som inte genomgick rigorösa säkerhetstester och strikt tillverkningstillsyn.
HHS "Partnerskap" med DoD kringgick civila skyddslagar
För att sammanfatta situationen med annan transaktionsmyndighet/överenskommelser med avseende på civila myndigheter i allmänhet och Covid mRNA-vacciner, i synnerhet:
- OTA skrevs och kodifierades som ett sätt för militären att skaffa vapen och annan nödvändig system och utrustning utan en massa byråkratisk byråkrati. Det omfattar forskning och utveckling, prototyper och efterföljande tillverkning.
- Den enda OTA för en folkhälsomyndighet är för HHS och den täcker bara forskning och utveckling, inte prototyper eller tillverkning.
- Även R&D OTA som ges till HHS kräver fortfarande att produkter tillverkas "i en form som uppfyller regulatoriska krav" för läkemedels- och vaccinsäkerhet.
Med andra ord: Det finns inget sätt HHS kunde ha använt sin mycket begränsade OTA för att underteckna kontrakt för hundratals miljoner nya medicinska produkter.
Så vad gjorde HHS?
Som Government Accountability Office (GAO) noterade i sin Juli 2021-rapport om "Covid-19-kontraktering:" HHS "samarbetade" med DoD för att "utnyttja DoD:s OTA-myndigheter ... vilket HHS saknade." (s. 24)
Vilka är DoD:s OT-myndigheter för medicinska produkter?
Som diskuterats är OTA tänkt att hjälpa militären att få utrustning och teknik utan massor av byråkratiskt krångel. Ingen av de ursprungliga lagarna som hänför sig till OTA nämnde något annat än "plattformar, system, komponenter eller material" avsedda att "förbättra uppdragseffektiviteten för militär personal."
Men fem år före Covid introducerades en exceptionell användning av OTA:
2015, DoD meddelade etableringen av CBRN Medical Countermeasure Consortium, vars syfte var att använda OTA-förvärvsvägen för att "samarbeta med DoD för att utveckla FDA-licensierade kemiska, biologiska, radiologiska och nukleära medicinska motåtgärder." [FDA = Food & Drug Administration]
Som beskrivits i 2015 års tillkännagivande inkluderade detta "prototypteknologier för terapeutiska medicinska motåtgärder inriktade på virala, bakteriella och biologiska toxinmål av intresse för DoD." Listan över medel inkluderade de främsta biokrigföringspatogenerna, såsom mjältbrand, ebola och marburg.
Tillkännagivandet fortsatte med att specificera att "möjliggörande teknologier kan inkludera djurmodeller av virus, bakteriell eller biologisk toxinsjukdom och patogenes (flera exponeringsvägar), analyser, diagnostiska tekniker eller andra plattformstekniker som kan användas för utveckling av godkända eller licensierade MCM:er [medicinska motåtgärder].”
Även om detta fortfarande inte låter som produktionen av 100 miljoner nya vacciner för civilt bruk, ger det mer spelrum för OTA än den mycket begränsade Other Transaction Authority som ges till HHS.
Medan HHS OTA kräver efterlevnad av omfattande utvecklings- och tillverkningsbestämmelser, kräver OTA-vägen för DoD att utveckla medicinska motåtgärder endast "FDA-licens."
Med hjälp av DoD Other Transaction Authorities skulle det alltså teoretiskt vara möjligt att kringgå alla säkerhetsföreskrifter – beroende på kraven för FDA-licensering av en OTA-genererad produkt. Som vi kommer att se, i fallet med Covid mRNA-vaccin, beviljades nödtillstånd för användning, vilket inte kräver någon laglig säkerhetstillsyn alls.
Tillstånd för nödsituationer (EUA)
Så här gör Food & Drug Administration (FDA) beskriver sina EUA-befogenheter:
Sektion 564 i FD&C Act (21 USC 360bbb – 3) tillåter FDA att stärka folkhälsoskyddet mot biologiska, kemiska, nukleära och radiologiska agens.
Med denna EUA-myndighet kan FDA hjälpa till att säkerställa att medicinska motåtgärder kan användas i nödsituationer för att diagnostisera, behandla eller förebygga allvarliga eller livshotande sjukdomar eller tillstånd orsakade av biologiska, kemiska, nukleära eller radiologiska agens när det inte finns några adekvata, godkända och tillgängliga alternativ (bland andra kriterier).
Det är oerhört viktigt att förstå att dessa EUA-befogenheter beviljades 2004 under mycket specifika omständigheter relaterade till beredskap för attacker med massförstörelsevapen, även kända som CBRN (kemiska, biologiska, radiologiska, nukleära) medel.
Som förklarats i Harvard Law's Bill of Health,
I slutändan var det kriget mot terrorismen som skulle ge upphov till nödtillstånd. Efter händelserna den 11 september 2001 och efterföljande antraxpostattacker, antog kongressen Project Bioshield Act från 2004. Lagen krävde miljarder dollar i anslag för att köpa vaccin som förberedelse för en bioterrorattack och för att lagra nödåtgärder. För att kunna agera snabbt i en nödsituation tillät kongressen FDA att godkänna formellt ej godkända produkter för akut användning mot ett hot mot folkhälsan och säkerheten (med förbehåll för en nödförklaring av HHS). De post indikerar att kongressen var fokuserad på hotet om bioterror specifikt, inte på att förbereda sig för en naturligt förekommande pandemi.
Smakämnen formuleringen av EUA-lagen Parlamentet understryker det faktum att det var avsett att användas i situationer som involverade massförstörelsevapen. Här är de fyra situationerna där EUA kan utfärdas:
- ett beslut av Secretary of Homeland Security att det finns en inhemsk nödsituation, eller en betydande potential för en inhemsk nödsituation, som innebär en ökad risk för attack med ett eller flera biologiska, kemiska, radiologiska eller nukleära medel;
- ett beslut av försvarsministern att det finns en militär nödsituation, eller en betydande potential för en militär nödsituation, som innebär en ökad risk för United Stater militära styrkor, inklusive personal som verkar under ledning av avdelning 10 eller avdelning 50, av attack med—
- ett eller flera biologiska, kemiska, radiologiska eller nukleära medel; eller
- ett eller flera medel som kan orsaka, eller på annat sätt förknippas med, en överhängande livshotande och specifik risk för United Stater militära styrkor;
- ett beslut av Sekreterare att det finns en nödsituation för folkhälsan, eller en betydande potential för en nödsituation för folkhälsan, som påverkar, eller har en betydande potential att påverka, nationell säkerhet eller Uniteds hälsa och säkerhet Stater medborgare som bor utomlands och som involverar ett eller flera biologiska, kemiska, radiologiska eller nukleära agens, eller en sjukdom eller ett tillstånd som kan hänföras till ett eller flera sådana agens; eller
- identifieringen av ett väsentligt hot enligt 319F–2 § i den Folkhälsovårdslagen [42 USC 247d–6b] tillräckligt för att påverka nationell säkerhet eller Uniteds hälsa och säkerhet Stater medborgare som bor utomlands.
Ingenstans i dessa fyra situationer nämns det något om en naturligt förekommande epidemi, pandemi eller någon annan typ av folkhälsosituation som inte orsakas av "biologiska, kemiska, radiologiska eller nukleära agenser."
Kan SARS-CoV-2 kvalificera sig som en sådan agent?
Om du letar efter definitionen av "biologiska medel” i USA:s rättsliga kod kommer du att gå följande väg:
Brott och straffprocesser -> Brott -> Biologiska vapen -> Definitioner
Så i samband med amerikansk lag betyder termen "biologiska agens" biologiska vapen, och användningen av sådana medel/vapen betraktas som ett brott.
Wikipedia tillhandahåller detta definition:
Ett biologiskt agens (även kallat bio-agent, biologiskt hotmedel, biologiskt krigföringsmedel, biologiskt vapen eller biovapen) är ett bakterie, virus, protozo, Parasiten, svamp, eller toxin som kan användas målmedvetet som ett vapen i bioterrorism or biologisk krigföring (BW).
På vilken rättslig grund utfärdades EUA för Covid-mRNA-vacciner?
Det verkar, baserat på lagarna om EUA, som om ingen av de fyra möjliga situationer som beskrivs i lagen skulle kunna tillämpas på en produkt som är avsedd att förebygga eller behandla en sjukdom orsakad av en naturligt förekommande patogen.
Ändå användes denna lag för att godkänna mRNA Covid-vaccinerna.
Med tanke på de fyra val som anges i EUA-lagen, var den som användes för Covid "motåtgärder"
C) ett beslut av Sekreterare att det finns en nödsituation för folkhälsan, eller en betydande potential för en nödsituation för folkhälsan, som påverkar, eller har en betydande potential att påverka, nationell säkerhet eller Uniteds hälsa och säkerhet Stater medborgare som bor utomlands och som involverar ett eller flera biologiska, kemiska, radiologiska eller nukleära agens, eller en sjukdom eller ett tillstånd som kan hänföras till ett eller flera sådana agens.
När tillämpas specifikt på Covid, så här var det formulerat:
sekreteraren för Department of Health and Human Services (HHS) fastställde att det finns en nödsituation för folkhälsan som har en betydande potential att påverka nationell säkerhet eller hälsan och säkerheten för amerikanska medborgare som bor utomlands, och som involverar viruset som orsakar Coronaviruset Sjukdom 2019 (COVID-19)...
Det råder ingen tvekan här om att "viruset som orsakar covid-19" anses motsvara "ett eller flera biologiska, kemiska, radiologiska eller nukleära medel."
Det är också viktigt att notera att EUA:s "fastställande av en nödsituation för folkhälsan" är helt skild från, och inte på något sätt beroende av, andra folkhälsoförklaringar, som de som gjordes av WHO, den amerikanska regeringen , och presidenten i början av Covid-19-pandemin.
Så även när WHO, USA:s regering och presidenten förklarar att pandemin är över, kan det fortfarande finnas nödtillstånd om HHS-sekreteraren fortsätter att hävda att situationen som beskrivs i avsnitt C) existerar.
Tittar på alla EU:er för hundratals Covid-relaterade medicinska produkter, är det mycket svårt att se hur HHS-sekreteraren skulle kunna motivera påståendet att "det finns en nödsituation för folkhälsan som har en betydande potential att påverka nationell säkerhet eller hälsan och säkerheten för amerikanska medborgare som bor utomlands" i de flesta, om inte alla, av dessa fall.
Ytterligare "lagstadgade kriterier" för FDA för att bevilja nödtillstånd
När väl HHS-sekreteraren förklarar att det finns en nödsituation för folkhälsan som motiverar EUA, baserat på en av de fyra situationer som anges i lagen, finns det ytterligare fyra "lagstadgade kriterier" som måste uppfyllas för att FDA ska kunna utfärda EUA . Så här förklarar FDA dessa krav:
- Allvarlig eller livshotande sjukdom eller tillstånd
För att FDA ska utfärda ett EUA måste CBRN-agensen som avses i HHS-sekreterarens EUA-deklaration kunna orsaka en allvarlig eller livshotande sjukdom eller tillstånd.
OBS: Detta kriterium upprepar specifikationen av ett CBRN-agent, som juridiskt definieras som ett vapen som används för att begå ett brott.
- Bevis på effektivitet
Medicinska produkter som kan komma i fråga för en EUA är de som "kan vara effektiva" för att förebygga, diagnostisera eller behandla allvarliga eller livshotande sjukdomar eller tillstånd som kan orsakas av ett eller flera CBRN-agens som identifierats i HHS-sekreterarens förklaring av nödsituation eller hot om nödsituation enligt avsnitt 564 (b).
Standarden "kan vara effektiv" för EUA ger en lägre nivå av bevis än den "effektivitet"-standard som FDA använder för produktgodkännanden. FDA avser att bedöma den potentiella effektiviteten av en möjlig EUA-produkt från fall till fall med hjälp av en risk-nytta-analys, som förklaras nedan.
[FET ANSIKTE TILLAGT]
JURIDISK FRÅGA: Hur kan någon juridiskt hävda att en produkt godkänd enligt EUA är "säker och effektiv" om den juridiska standarden för EUA är "kan vara effektiv" och FDA förklarar att detta är en "lägre bevisnivå" än den standard som används för vanliga produktgodkännanden?
- Risk-nytta analys
En produkt kan komma i fråga för en EUA om kommissionären fastställer att de kända och potentiella fördelarna med produkten, när den används för att diagnostisera, förebygga eller behandla den identifierade sjukdomen eller tillståndet, uppväger de kända och potentiella riskerna med produkten.
Vid fastställandet av om de kända och potentiella fördelarna med produkten uppväger de kända och potentiella riskerna, FDA tänker titta på den totala vetenskapliga bevisningen för att göra en övergripande bestämning av risk-nytta. Sådana bevis, som kunde uppstå från en mängd olika källor, kan innehålla (men är inte begränsat till): resultat från inhemska och utländska kliniska prövningar, in vivo-effektdata från djurmodeller och in vitro-data, tillgänglig för FDA-övervägande. FDA kommer också att bedöma kvaliteten och kvantiteten av tillgängliga bevis, med tanke på det aktuella läget för vetenskaplig kunskap.
[FET ANSIKTE TILLAGT]
JURIDISK ANMÄRKNING: Det finns ingen juridisk standard och det finns inga juridiska definitioner för vad det betyder att "kända och potentiella fördelar" uppväger "kända och potentiella risker". Det finns inte heller någon kvalitativ eller kvantitativ juridisk definition av vad som utgör acceptabelt "tillgängligt bevis" som risk-nytta-analysen "kan baseras på". Det kan finnas noll faktiska bevis, men en övertygelse om att en produkt har många potentiella fördelar och inte mycket potentiella risker, och det skulle uppfylla detta "lagstadgade krav."
- Inga alternativ
För att FDA ska utfärda ett EUA måste det inte finnas något adekvat, godkänt och tillgängligt alternativ till kandidatprodukten för att diagnostisera, förebygga eller behandla sjukdomen eller tillståndet. En potentiell alternativ produkt kan anses vara "inte tillgänglig" om det inte finns tillräckliga förråd av det godkända alternativet för att fullt ut tillgodose nödbehovet.
JURIDISK FRÅGA: Bortsett från den grova och potentiellt kriminella smutskastningen/förbjuden av alternativa Covid-19-behandlingar som ivermektin och hydroxiklorokin, vid vilken tidpunkt fanns det ett godkänt alternativ för att "förebygga Covid-19" (det enda mRNA-vaccinerna köptes för att göra ) – Paxlovid, till exempel – vilket skulle göra att en EUA för mRNA-vaccinerna inte längre är laglig?
Här är hur alla dessa "lagstadgade kriterier" uppfylldes i själva verket Nödtillstånd för användning av BioNTech/Pfizer Covid mRNA-vacciner:
Jag har dragit slutsatsen att akutanvändningen av Pfizer-BioNTech COVID-19-vaccin för att förebygga covid-19 när det administreras enligt beskrivningen i omfattningen av auktorisationen (avsnitt II) uppfyller kriterierna för utfärdande av ett tillstånd enligt avsnitt 564(c) i lagen, eftersom:
- SARS-CoV-2 kan orsaka en allvarlig eller livshotande sjukdom eller tillstånd, inklusive allvarliga luftvägssjukdomar, hos människor som är infekterade av detta virus;
- Baserat på alla vetenskapliga bevis som är tillgängliga för FDA, är det rimligt att tro att Pfizer-BioNTech COVID-19-vaccin kan vara effektivt för att förebygga covid-19, och att de kända och potentiella fördelarna med Pfizer-BioNTech COVID-19-vaccin när de används under de villkor som beskrivs i detta tillstånd när det används för att förebygga covid-19 uppväga dess kända och potentiella risker; och
- Det finns inget lämpligt, godkänt och tillgängligt alternativ till akutanvändning av Pfizer-BioNTech COVID-19-vaccin för att förebygga covid-19.
[FET ANSIKTE TILLAGT]
OBS: Det enda sammanhang där FDA vägde de potentiella fördelarna och riskerna med vaccinet och där FDA fastställde att det "kan vara effektivt" var för att förebygga Covid-19.
Det finns inget hänsynstagande, inga bevis för faktiska eller potentiella fördelar och inget beslut om att det finns någon potentiell effektivitet för vaccinet att göra något annat, inklusive: minska risken för allvarlig sjukdom, minska risken för sjukhusvistelse, minska risken för dödsfall , vilket minskar risken för tillstånd som faktiskt eller potentiellt är relaterade till Covid-19.
DÄRFÖR kan man rimligen ifrågasätta lagligheten av alla påståenden om att vaccinet är "säkert och effektivt" i samband med något annat än "när det används för att förebygga covid-19" - vilket vaccinerna var känt att INTE GÖR mycket snart efter att de infördes.
Om människor fick höra att BioNTech/Pfizer mRNA-vaccinerna var "säkra och effektiva" för något annat än att förebygga Covid-19, och om de hotades med några konsekvenser för att de inte tog vaccinet för något annat än att förhindra Covid-19, skulle de kunna har ett legitimt argument för att de olagligt tvingades att ta en ogodkänd produkt under bedrägliga påståenden?
Tredje nivåskrav för EUA för ej godkända produkter
När vi har den EUA-specifika nöddeklarationen, och när FDA deklarerar att produkten kan vara effektiv och att alla bevis som finns tillgängliga (från noll till oändlighet) visar att dess fördelar överväger riskerna (som bestäms av vad FDA än tror att de kan vara), finns det ytterligare ett lager av icke-säkerhetsrelaterad reglering.
Här är hur en 2018 Congressional Research Service rapport om EUA förklarar detta:
FFDCA §564 uppmanar FDA att införa vissa obligatoriska villkor i en EUA och tillåter ytterligare diskretionära villkor där så är lämpligt. De erforderliga villkoren varierar beroende på om EUA är för en icke godkänd produkt eller för en icke godkänd användning av en godkänd produkt. För en icke godkänd produkt måste användarvillkoren:
(1) säkerställa att vårdpersonal som administrerar produkten får nödvändig information;
(2) säkerställa att individer till vilka produkten administreras får nödvändig information;
(3) tillhandahålla övervakning och rapportering av biverkningar i samband med produkten; och
(4) se till att tillverkaren registrerar och rapporterar.
JURIDISK FRÅGA: Vad exakt är den "obligatoriska informationen?" Vi vet att människor informerades om att vaccinerna fick nödtillstånd. Men fick de veta att detta betyder "en lägre nivå av bevis" än vad som krävs för "säkra och effektiva" påståenden om andra medicinska produkter? Blev de informerade om att det finns olika nivåer av "säker och effektiv" beroende på om en produkt har EUA eller annan typ av godkännande?
OBS: Lagen kräver att det finns ett sätt att övervaka och rapportera negativa händelser. Däremot står det inte vem som övervakar, vilka standarder som gäller för rapportering och vad tröskeln är för att vidta åtgärder utifrån rapporterna.
EUA jämfört med alla andra läkemedels-/vaccingodkännanden
Som forskare/skribent Sasha Latypova har påpekat att många människor blev förvirrade av EUA, eftersom det låter mycket som EAU, som står för "Expanded Access Use." Detta är en typ av tillstånd som ges till medicinska produkter när det finns ett akut behov av en viss grupp patienter (t.ex. cancerpatienter i stadium IV vars förväntade livslängd mäts i månader) som är villiga att riskera biverkningar och till och med döden i utbyte mot tillgång till en experimentell behandling.
Auktorisering för nödbruk är inte på något sätt relaterad till, och har inte heller någon likhet med, utökad åtkomstanvändning.
De olika juridiska vägarna för att godkänna medicinska produkter presenteras prydligt i en tabell som markerats av juridisk forskare Katherine Watt. Tabellen är en del av en presentation 2020 för en FDA-CDC Joint Learning Session: Regelverksuppdateringar om användning av medicinska motåtgärder.
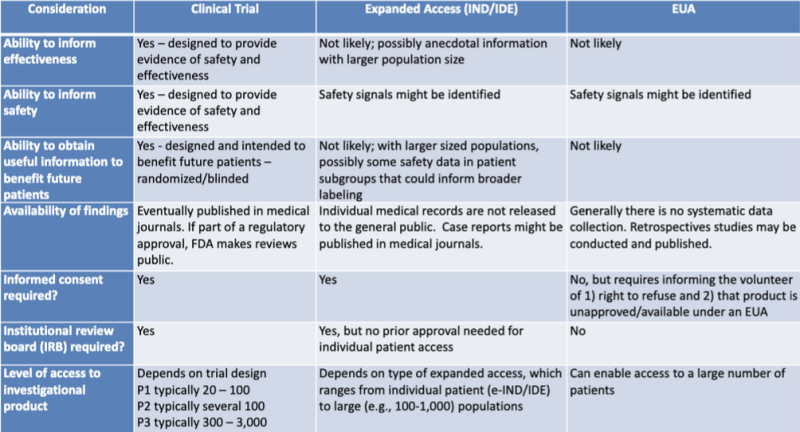
Denna tabell visar mycket tydligt att EUA-processen sannolikt inte kommer att ge information om produktens effektivitet, inte är utformad för att ge bevis på säkerhet, sannolikt inte kommer att ge användbar information till nytta för framtida patienter, involverar ingen systematisk datainsamling, kräver inga retrospektiva studier, inget informerat samtycke och ingen institutionell granskningsnämnd.
Dessutom i en 2009 Institute of Medicine av National Academic publikation, även markerad av Watt, med titeln "Medical Countermeasures: Dispensing Emergency Use Authorization and the Postal Model – Workshop Summary" finner vi detta uttalande på sid. 28:
Det är viktigt att inse att en EUA inte är en del av utvecklingsvägen; det är en helt separat enhet som endast används i nödsituationer och är inte en del av läkemedelsgodkännandeprocessen.
Betyder detta att godkännanden av Covid-19 motåtgärder som var baserade på EUA var olagliga? Betyder det att det inte finns något lagligt sätt att hävda att en EUA-produkt är "säker och effektiv" eftersom den INTE ÄR EN DEL AV LÄKEMEDELSGODKÄNNANDEPROCESSEN?
Slutsats
Det är ytterst uppenbart, med tanke på all information i den här artikeln och i föregående del 1, att BioNTach/Pfizer Covid mRNA-vaccinerna utvecklades, tillverkades och godkändes enligt militära lagar reserverade för nödsituationer som involverar biologisk krigföring/terrorism, inte naturligt förekommande sjukdomar som påverkar hela civilbefolkningen.
Därför var efterlevnaden av regler och tillsyn som vi förväntar oss att hitta när en produkt bedöms som "säker och effektiv" för hela civilbefolkningen inte lagstadgat.
Kan denna analys användas för att ifrågasätta lagligheten av det "säkra och effektiva" påståendet från de regeringstjänstemän som visste vad EUA innebar? Finns det andra juridiska konsekvenser?
Jag hoppas det.
Viktigt är att i juridiska utmaningar mot Covid-mRNA-vacciner som hittills kommit in, har det inte funnits några avgöranden (som jag är medveten om) om huruvida militär lag, som OTA och EUA, kan tillämpas på civila situationer. Det har dock funnits ett uttalande av tingsrättsdomaren Michael Truncale, i hans avskedande av ärendet om meddelare Brook Jackson mot Ventavia och Pfizer, det är viktigt att ha i åtanke.
Här erkänner domaren att avtalet för BioNTech/Pfizer mRNA-vaccinerna var en militär OTA, men han vägrar att uttala sig om dess tillämplighet på de icke-militära omständigheter (naturligt förekommande sjukdomar, 100 miljoner doser oftast inte för militärt bruk) under vilka det utfärdades:
Det faktum att både militär personal och civila fick vaccinet tyder inte på att anskaffningen av vaccinet var irrelevant för att förbättra militärens uppdragseffektivitet. Ännu viktigare är att Jackson i själva verket ber denna domstol att upphäva DoD:s beslut att utöva Other Transaction Authority för att köpa Pfizers vaccin. Men som USA:s högsta domstol länge har betonat, är de "komplexa subtila och professionella besluten om sammansättning, utbildning, utrustning och kontroll av en militär styrka i huvudsak professionella militära bedömningar." Gilligan v. Morgan, 413 US 1, 10 (1973). Således är det "svårt att föreställa sig ett område för statlig verksamhet där domstolarna har mindre kompetens." Id. Denna domstol kommer inte att lägga in sitt veto mot DoD:s domar om uppdragets effektivitet under en nationell nödsituation.
Detta är bara ett av många juridiska hinder som återstår i kampen för att slutligen förbjuda alla mRNA-produkter som godkänts under Covid-19-nödsituationen, och alla efterföljande mRNA-produkter vars godkännande baserades på Covid-19-godkännandeprocessen.
Publicerad under a Creative Commons Erkännande 4.0 Internationell licens
För omtryck, vänligen ställ tillbaka den kanoniska länken till originalet Brownstone Institute Artikel och författare.









